放射光真空紫外円二色性によるタンパク質の構造解析
概要
広島大学放射光科学研究センター(HSRC)のBL15では、放射光源を用いることにより、世界で初めて水溶液中で140 nmまでの短波長領域で円二色性(Circular Dichroism:CD)スペクトルが測定できる、真空紫外円二色性(VUVCD)分散計の開発に成功した。本装置を用いて天然タンパク質のVUVCDスペクトルを測定した結果、市販の装置に比べて格段に高精度で二次構造の解析が可能になり、構造未知タンパク質の構造予測への応用が可能となった。また、本装置は、これまで未解明であったタンパク質の変性状態の構造についても、他の方法では得られない新規な情報を提供し、その有用性が示された。本装置は、タンパク質に限らず、様々な生体分子への応用が可能で、新世代の構造解析法として期待される。
背景
タンパク質の立体構造は、その機能を理解する上で極めて重要であり、そのため、X線結晶学やNMR分光法などの原子レベルでの構造解析法が広く利用されている。しかし、これらの方法では、タンパク質試料の結晶化の必要性や分子量の制限などのため、構造解析が困難なケースも多く存在する。対照的に、CD分光法は、得られる情報はタンパク質の二次構造に限られるが、様々な種類のタンパク質を簡単にしかも微量で測定でき、さらに温度やpH等の溶媒変化にも対応できるため、X線やNMRでは測定困難なタンパク質の水中での天然状態や非天然状態の構造解析法として広く利用されている。しかし、通常光源を用いた市販のCD装置では、水や大気の光吸収や光学システムの問題のため、水溶液中では190 nm付近の短波長領域までしか測定できず、得られる構造情報に限界があった。190 nm以下の真空紫外(Vacuum-Ultraviolet: VUV)領域には、高エネルギー遷移に基づいたCDが観測され、より詳細で新規なタンパク質の構造情報を得ることができるため、放射光源を用いたVUVCD分散計の開発が強く望まれていた。
このようなVUVCD装置の開発は、1980年代初頭、アメリカのBrookhaven National Laboratoryで初めて行われ、近年では、イギリスのSynchrotron Radiation Source、デンマークのAarhus Storage Ring、ドイツのBerlin Electron Storage Ring Company for Synchrotron Radiationで開発され稼動している。さらに、中国のUniversity of Science and TechnologyやBeijing Synchrotron Radiation Facility、ブラジルのCampinas National Synchrotron Light Laboratory、フランスのSynchrotron SOLEIL、オーストラリアのMelbourneでは開発中であり、各国の関心が高まっている。特にイギリスのグループは、CD装置用として3本のビームラインを確保し、精力的にVUVCD装置の開発・研究に取り組んでいる。しかし現時点では、これら各国の装置はすべて窒素雰囲気中でしか測定できず、短波長限界は170 nm付近で止まっている。
このような状況の中、1997年に広島大学放射光科学研究センター(HSRC)が設置され、研究室に密着した放射光利用が可能となった。この放射光源(0.7 GeV)は軟X線領域の研究には最適であり、我々はこのビームライン15(Fig. 1)を用いて、光学系をすべて高真空下(10-4 Pa)に保持し、また光サーボリファレンス方式を導入することで高精度のCD位相変調を可能にし、2000年、世界に先駆けて水溶液で140 nmまでCD測定が可能なVUVCD分散計を開発した(Fig. 2)。本装置を用いて、これまですでに多くの実績を挙げてきたが1)、本稿では、タンパク質の天然状態と非天然状態の構造解析への応用について紹介する。

Fig. 1 広島大学放射光科学研究センターのビームライン15
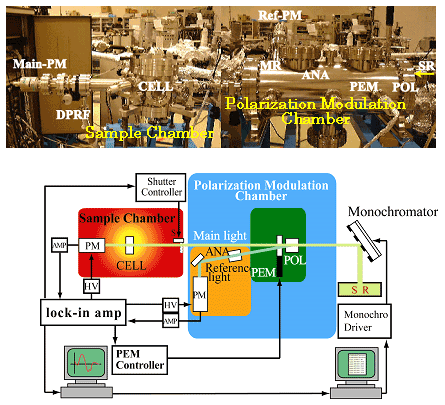
Fig. 2 真空紫外円二色性(VUVCD)分散計
研究内容
天然状態の構造解析2) これまで測定した31種類の天然タンパク質の中から、典型的な4種のタンパク質のVUVCDスペクトル(260-160 nm)をFig. 3に示す。ミオグロビンなどのα-helixのみからなるタンパク質(α-protein)のスペクトルでは、これまで知られている222 と 208 nm付近の負、190 nm付近の正のCDピークの他に、80 nm付近に肩、170 nm付近に負のピークが観測され、160 nm以下にも正のピークが示唆される。一方、α-proteinと比べ、β-strandを多く含んだタンパク質(β-protein)のVUVCDスペクトルは、2つの負のピークが230-220と175-170 nm付近に存在し、また、2つの正のピークが200-190 と165 nm付近で観測される。このように各タンパク質は、190nm以下のVUV領域において、それぞれの二次構造を敏感に反映したスペクトルを示すことが、本装置により初めて明らかになった。
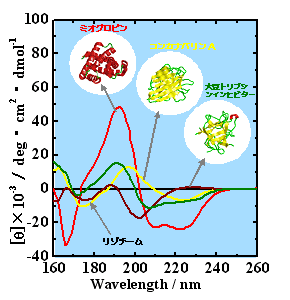
Fig. 3 水溶液中のタンパク質のVUVCDスペクトル
X線構造既知の31種類のタンパク質のVUVCDスペクトルから、特異値分解法を用いて算出した、4種の二次構造成分(α-helix、β-strand、turn、unordered structure)の260-160 nm 領域でのCD成分スペクトルをFig. 4に示す。それぞれの二次構造は、190 nm以下のVUV領域において市販のCD装置では得ることができない特徴的なスペクトルを示している。このように、VUVCDスペクトルは、より多くの二次構造情報を含んでおり、精度の高い構造解析を可能とする。
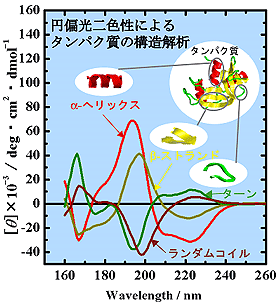
Fig. 4 タンパク質二次構造の成分スペクトル
上記の成分スペクトルを用いて、31種類のタンパク質の二次構造(α-helix、β-strand、turn、unordered structure)の含有率を、解析プログラムSELCON3により見積もった。予測精度の指標として、X線結晶構造との自乗平均偏差(δ)と相関係数(γ)を計算した。α-helix、β-strand、二次構造全体に対する の値を、スペクトル測定の短波長限界に対してプロットした結果をFig. 5に示す。適用波長を短波長側に広げることで、いずれの 値も大きく減少したことから、CD測定のVUV領域への拡張により、二次構造含有率の予測精度が格段に向上することが示された。160 nmまでのスペクトルを用いて予測されたα-helix、β-strandの含有率を、X線結晶構造の結果に対してプロットした図をFig. 6a, bに示す。α-helixの予測値はX線構造と良く一致しており、β-strandも高い精度(相関係数γ=0.826)で予測できることが分かった。また、VUV領域への拡張によって、市販のCD装置では難しかったα-helixとβ-strandの本数を見積もることも可能となった。Fig. 6c, dに示すように、VUVCDスペクトルからの予測値は、α-helix、β-strandいずれも X線構造の結果とよく一致している。これらの結果は、VUVCD分光法が、構造未知な天然タンパク質の二次構造予測に有力な手段となることを示している。
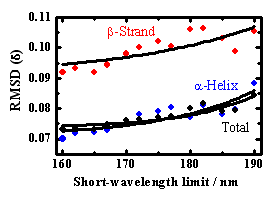
Fig. 5 波長拡張による予測精度( )の変化
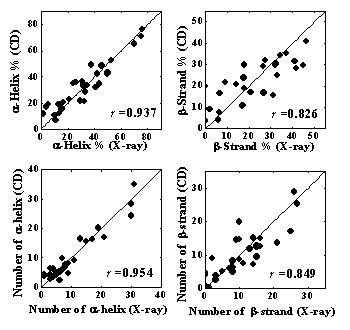
Fig. 6 X線とVUVCDから見積もられた二次構造含有率と本数の比較
非天然状態の構造解析3) Fig. 7aに、酸、低温、熱変性状態のミオグロビンのVUVCDスペクトル(260-172 nm)示す。また、比較のため、塩酸グアニジン変性状態(完全変性)の197 nmまでのスペクトルを示す。挿入図に示したCDの温度依存性から、ミオグロビンは-12℃でほぼ低温変性していることが分かる。上述の二次構造解析法を用いて各変性状態のα-helix、β-strand、turn、poly-L-proline type II (PPII)、unordered structureの二次構造含有率を予測した結果をFig.7bに示す。それぞれの二次構造含有率は変性の種類に依存するものの、どの変性状態でも共通してα-helixは減少し、PPIIとunordered structureは増加している。しかし、興味深いことにβ-strandは増加の傾向を示し、酸変性状態で15%も形成されている。しかし、酸変性状態のNMR解析ではβ-sheetが観測されていないことから、予測されたβ-strandは、天然状態で一般に観測されるペプチド間水素結合からなるβ-sheet ではなく、β-strandに近い二面角をもった短いペプチド鎖(distorted-β-strand)に帰属される。さらに、α-helixに関しても、正常なへリックス構造の他に、α-helixの二面角を持つ局所的な構造(distorted-α-helix)が存在していると考えられる。他のタンパク質についても変性状態のVUVCDスペクトルを解析した結果、タンパク質の変性状態の一般的な構造は、α-helix、β-sheet、distorted α-helix、distorted β-strand、turn、PPII、unordered structureの集合体であることが分かってきた。これらの二次構造の量や位置は、変性条件やタンパク質の特性で異なっており、特定の溶媒環境やタンパク質濃度ではmiss-foldingにより分子間β-sheetが形成され、会合やアミロイド形成が起こり、病気の原因になるものと思われる。このように、VUVCD分光法は変性タンパク質の構造に対しても、新規で重要な情報を提供することができる。
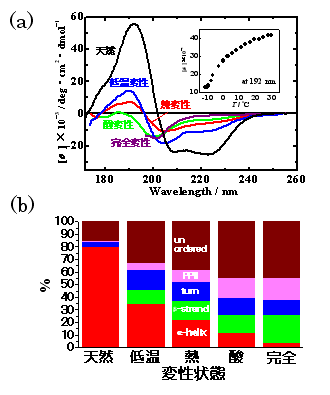
Fig. 7 酸・低温・熱変性状態のミオグロビンのVUVCDスペクトルと各状態での二次構造含有率
本研究の意義
本装置は、世界で初めて水溶液中で140 nmまでのVUV領域でCDスペクトル測定を可能にした実用機であり、これまで不可能であった高エネルギー遷移のCD情報を取り込むことにより、タンパク質の詳細な二次構造解析を可能にしている。本手法は、X線結晶構造解析やNMR分光法では困難な膜タンパク質や糖タンパク質、さらには、DNA-タンパク質、脂質-タンパク質複合体の構造解析にも容易に応用できる。現在、VUVCDスペクトルから得られる構造情報にアミノ酸配列情報を組み込むことにより、タンパク質の二次構造の位置を残基レベルで予測できる新規構造解析プログラムも開発中である。本研究で得られたデータは、イギリスのWallace教授を中心に各国の放射光CDメンバーと共同で開発中の、タンパク質CDデータバンク(PCDDB)に登録され、将来、タンパク質の構造解析法として生命科学の発展に大きく貢献するものと期待される。また、本装置は、このようなタンパク質の構造解析だけでなく、有機化学・薬学・医学・農学など多くの分野で応用が可能であり、その重要性は益々高まるものと期待される。
参考文献
1)日本放射光学会誌 17, 118 126 (2004).
2)J. Biochem. 138, 79 88 (2005).
3)Biophy. J. 2007年6月号に掲載予定.











